1. Hubungan Mol dengan Massa Zat
Untuk unsur
Untuk senyawa
Keterangan:
m = massa (gram)
n = mol
Ar = massa atom relatif
Untuk senyawa Mr = massa molekul relatif
Contoh soal
1. Tentukan massa dari 2 mol amoniak (Mr NH3 = 17)
Jawab:
m= n x Mr = 2 x 17 = 28 gram
2. Hitunglah jumlah mol dari besi dengan massa 28 gram ( Ar Fe = 56)
Jawab:
n = m / Ar = 28/56 = 0,5 mol
2. Hubungan Mol dengan partikel
Jumlah partikel dalam 1 mol (12 gram C-12) yang ditetapkan melalui eksperimen dan didapatkan
6,02 x 10 23. Selanjutnya bilangan 6,02 x 10 23 disebut sebagai tetapan Avogadro dengan lambang L


Keterangan:
n = mol
N = Jumlah partikel/atom/molekul
NA = konstanta Avogadro(6,02 x 1023)
Contoh soal :
1. Tentukan jumlah atom tembaga dalam 2 mol tembaga!
Jawab:
N = n x NA= 2 x 6,02 .10 23 = 12,04. 1023 atom
2. Hitunglah jumlah mol dalam 3,01 x 1025 molekul O2!
Jawab:

= 50 mol
3. Hubungan Mol dengan Volume
"Pada suhu dan tekanan yang sama, gas-gas yang volumenya sama mengandung jumlah mol yang sama. Dari pernyataan ini ditentukan bahwa pada keadaan STP (0o C 1 atm) 1 mol setiap gas volumenya 22.4 liter volume ini disebut sebagai volume molar gas.


Keterangan
V STP (liter)= volume pada kondisi STP (0o C 1 atm)
n = mol
Pada suhu dan tekanan yang bukan standar (suhu ≠ 00 C , tekanan ≠ 1atm), maka volume dapat dihitung dengan persamaan gas ideal

Keterangan :
P = tekanan gas (atm)
V = volume gas
n = jumlah mol
R = tetapan gas 0,082 L atm/mol K
T = Suhu mutlak gas (Kelvin )
0 Kelvin = 273 0C
Contoh:
1. Berapa volume 8.5 gram amoniak (NH3) pada suhu 273o C dan tekanan 1 atm ?
(Ar: H = 1 ; N = 14)
Jawab:
mol amoniak = m/Mr = 8,5/ (Ar N +3 Ar H) = 8,5 / 14+ 3 = 8,5 /17 = 0,5 mol
Volume amoniak (STP) = 0.5 x 22.4 = 11.2 liter
2. Berapa liter volume 9 gram uap air (Mr =18) yang diukur pada keadaan 270 C dan tekanan 1 atmosfer?
Jawab:
Mol air = m/Mr = 9/18 = 0,5 mol
T = 27 + 273 = 300 Kalvin
PV = nRT

Soal latihan
1. Tentukan massa SO3 yang mengandung jumlah partikel sebanyak 3,01 x 10 21 molekul! (Ar S =32, O=16, L=6,02 . 1023)
2. Hitunglah massa atom relatif 11 gram gas Y dengan volume pada keadaan STP!
3. Jumlah atom dalam 3 mol metana (CH4)!
4. Hitunglah massa dari 10 liter gas butana (C4H10) diukur pada 250C dan tekanan 100 atm! (Ar C= 12, H =1)!
5. Pada tekanan dan suhu tertentu , 500 ml gas H2 mengandung n molekul. Hitunglah jumlah molekuk gas NH3 yang pada kondisi tersebut volumenya 100 ml!





 Ikatan Hidrogen dan ikatan Van der Waals Gaya antarmolekul adalah gaya elektromagnetik yang terjadi antara molekul atau antara bagian y...
Ikatan Hidrogen dan ikatan Van der Waals Gaya antarmolekul adalah gaya elektromagnetik yang terjadi antara molekul atau antara bagian y...
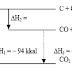 http://kimia-asyik.blogspot.com/search/label/Soal-Soal Soal Ulangan Hidrokarbon 1. Tentukan jumlah atom C primer, sekunder, tersie...
http://kimia-asyik.blogspot.com/search/label/Soal-Soal Soal Ulangan Hidrokarbon 1. Tentukan jumlah atom C primer, sekunder, tersie...
 Kimia inti adalah kajian mengenai perubahan-perubahan dalam inti atom. Perubahan ini disebut reaksi inti. Peluruhan radioaktif dan t...
Kimia inti adalah kajian mengenai perubahan-perubahan dalam inti atom. Perubahan ini disebut reaksi inti. Peluruhan radioaktif dan t...
 Kelompok Bajak Laut Topi Jerami adalah kelompok bajak laut fiktif yang ada dalam cerita manga dan anime One Piece . kelompok bajak l...
Kelompok Bajak Laut Topi Jerami adalah kelompok bajak laut fiktif yang ada dalam cerita manga dan anime One Piece . kelompok bajak l...
 http://kimia-asyik.blogspot.com/2010/01/hidrolisis-garam.html Reaksi asam dan basa menghasilkan garam. Asam terdiri dari asam kuat dan as...
http://kimia-asyik.blogspot.com/2010/01/hidrolisis-garam.html Reaksi asam dan basa menghasilkan garam. Asam terdiri dari asam kuat dan as...






