http://kimia-asyik.blogspot.com/2009/10/konsep-mol.html
http://kimia-asyik.blogspot.com/2009/11/sistem-koloid.html
Pengantar
Keadaan koloid bukan ciri dari zat tertentu karena semua zat, baik padat, cair, maupun gas, dapat dibuat dalam keadaan koloid.
ngkapku
http://kimia-asyik.blogspot.com/2009/11/larutan-elektrolit-dan-non-elektrolit.html
1. Larutan Elektrolit
Larutan yang dapat menghantarkan listrik karena mengalami proses ionisasi(terurai menjadi ion positif dan negatif). Ion-ion itu mengandung muatan listrik yang dapat menghantarkan listrik. Jika diuji dengan alat uji elektrolit menyebabkan lampu menyala terang atau redup dan timbul gelembung gas .
http://kimia-asyik.blogspot.com/2009/11/penentuan-bilangan-oksidasi-biloks.html
Penentuan Bilangan Oksidasi (biloks)
Untuk memudahkan kita dalam mengetahui reduktor (zat yang mengalami oksidasi) dan oksidator (zat yang mengalami reduksi), maka kepada masing-masing atom diberikan suatu harga yang disebut bilangan oksidasi atau tingkat oksidasi.Bilangan oksidasi didefinisikan sebagai muatan yang dimiliki suatu atom jika elektron diberikan kepada atom lain yang keelektronegatifannya lebih besar.
Ikatan Hidrogen dan ikatan Van der Waals
a. Ikatan Hidrogen
Dalam kimia, ikatan hidrogen adalah sejenis
http://kimia-asyik.blogspot.com/2010/05/manfaat-air-putih-bagi-tubuh_30.html
Meski wujudnya tidak neko-neko air (putih) memiliki manfaat yang tidak main-main bagi tubuh kita. Air sangat berperan dalam menjaga kelancaran sistem tubuh. Kalau dijabarkan, inilah manfaat air bagi tubuh kita:Mencerna makanan dan melarutkan nutrisi sehingga dapat diedarkan di sistem pencernaan
Membawa produk sisa ke luar tubuh
Mengirim pesan di antara sel-sel yang mengoordinasikan kerja organ-organ tubuh
http://kimia-asyik.blogspot.com/search/label/Soal-Soal
Soal Ulangan Hidrokarbon
Tahukah Anda, bahan-bahan dapur seperti bawang putih dan cabai merah dapat membasmi hama tanaman? Menurut Guntoro, staf alhi perkebunan Taman Buah Mekarsari, pestisida atau pembasmi hama tanaman yang berasal dari bahan alami lebih ramah lingkungan dan mudah membuatnya.
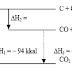
http://kimia-asyik.blogspot.com/2009/12/penentuan-entalpi-reaksi.html
1. Penentuan ∆H Reaksi berdasarkan Eksperimen (Kalorimeter)Penentuan kalor reaksi secara kalorimetris merupakan penentuan yang didasarkan atau diukur dari perubahan suhu larutan dan kalorimeter dengan prinsip perpindahan kalor, yaitu jumlah kalor yang diberikan sama dengan jumlah kalor yang diserap.
Kalorimeter adalah suatu sistem terisolasi (tidak ada pertukaran materi maupun energi dengan lingkungan di luar kalorimeter). Dengan demikian, semua kalor yang dibebaskan oleh reaksi yang terjadi dalam kalorimeter, kita dapat menentukan jumlah kalor yang diserap oleh air serta perangkat kalorimeter berdasarkan rumus :
q.larutan = m c ∆T
q.kalorimeter = C ∆T
q = jumlah kalor
m = massa air (larutan) di dalam kalorimeter
senyawa kovalen atau kovalen koordinasi.Teori hibridisasi dipromosikan oleh kimiawan Linus Pauling dalam menjelaskan struktur molekul seperti metana (CH4). Secara historis, konsep ini dikembangkan untuk sistem-sistem kimia yang sederhana, namun pendekatan ini selanjutnya diaplikasikan lebih luas, dan sekarang ini dianggap sebagai sebuah heuristik yang efektif untuk merasionalkan struktur senyawa organik.
http://kimia-asyik.blogspot.com/2009/12/grafik-orde-reaksi.html
Orde reaksi menyatakan pangkat dari konsentrasi, maka bentuk grafiknya merupakan grafik perpangkatan.http://kimia-asyik.blogspot.com/2010/01/titrasi-asam-basa.html
http://kimia-asyik.blogspot.com/2010/01/larutan-penyangga.html
http://kimia-asyik.blogspot.com/2010/01/hidrolisis-garam.html
Reaksi asam dan basa menghasilkan garam. Asam terdiri dari asam kuat dan asam lemah. Demikian juga basa, ada yang termasuk ke dalam basa kuat ada juga yang merupakan basa lemah.
Beberapa contoh asam kuat:
H2SO4.......asam sulfat
HCl..........asam klorida
HBr.........asam bromida
Sistem Periodik Unsur
Unsur-unsur yang ada di alam dikelompokkan ke dalam 2 kelompok yaitu logam dan non logam. Pengelompokan ini merupakan metode paling sederhana , dilakukan dengan cara mengamati
ciri-ciri fisiknya
●Bentuk molekul tergantung pada susunan ruang pasangan elektron ikatan (PEI
dan pasangan elektron bebas (PEB) atom pusat dalam molekul. Dapat dijelaskan
dengan teori tolakan pasangan elektron kulit valensi atau
Konsep Redoks
Just another WordPress.com weblog
* Home
* BENZENA DAN TURUNANNYA
BENZENA DAN TURUNANNYA
BENZENA DAN TURUNANNYA
1. RUMUS STRUKTUR BENZENA MENURUT KEKULE
Menurut Friedrich August Kekule, Jerman (1865), strukur Benzena dituliskan sebagai cincin dengan enam atom karbon yang mengandung tiga buah ikatan tunggal dan tiga buah ikatan rangkap yang berselang seling. Kerangka atom karbon dalam benzena membentuk segienam beraturan dengan sudut ikatan sebesar 1200.
(Benzena tidak sama dengan bensin. Benzena merupakan senyawa golongan aromatik dikenal aromatik karena berbau sedap, sedangkan bensin merupakan campuran senyawa alkana.
Rumus molekul : C6H6
http://rahmadonna.tripod.com/link2.html
Gugus fungsi merupakan bagian yang aktif dari suatu senyawa karbon. Apabila senyawa karbon yang memiliki gugus fungsi bereaksi dengan suatu zat, maka gugus fungsi itu akan mengalami perubahan, sedangkan bagian yang lain umumnya tetap. Berdasarkan gugus fungsi yang dimilikinya, senyawa-senyawa karbon dikelompokkan kedalam kelompok alkohol, eter, aldehid, keton, asam karboksilat, ester.
Gugus fungsi merupakan bagian yang aktif dari suatu senyawa karbon. Apabila senyawa karbon yang memiliki gugus fungsi bereaksi dengan suatu zat, maka gugus fungsi itu akan mengalami perubahan, sedangkan bagian yang lain umumnya tetap. Berdasarkan gugus fungsi yang dimilikinya, senyawa-senyawa karbon dikelompokkan kedalam kelompok alkohol, eter, aldehid, keton, asam karboksilat, ester.
Buat yang suka begadang, pasti tahu kan kalau begadang sangat tidak baik buat kesehatan. Bahkan kurang tidur bisa menyebabkan kematian, di tambah lagi kalau setelah begadang langsung mandi. Katanya bisa kena “Masuk Angin Stadium 5″ loh..!!

| | A. MENURUT ARRHENIUS Menurut teori Arrhenius, zat yang dalam air menghasilkan ion H + disebut asam danbasa adalah zat yang dalam air terionisasi menghasilkan ion OH - . HCl --> H + + Cl - NaOH --> Na + + OH - Meskipun teori Arrhenius benar, pengajuan desertasinya mengalami hambatan berat karena profesornya tidak tertarik padanya. Desertasinya dimulai tahun 1880, diajukan pada 1883, meskipun diluluskan teorinya |
bagi kelas XI a 1 iseng-iseng b baco yang ini, kan kito baru dikit belajar tentang stokiomeri :
Pada stoikiometri larutan, di antara zat-zat yang terlibat reaksi, sebagian atau seluruhnya berada dalam bentuk larutan.
1. Stoikiometri dengan Hitungan Kimia Sederhana
Soal-soal yang menyangkut bagian ini dapat diselesaikan dengan cara hitungan kimia sederhana yang menyangkut hubungan kuantitas antara suatu komponen dengan komponen lain dalam suatu reaksi.
Langkah-langkah yang perlu dilakukan adalah:
a. menulis persamann reaksi
b. menyetarakan koefisien reaksi
c. memahami bahwa perbandingan koefisien reaksi menyatakan perbandingan mol
Karena zat yang terlibat dalam reaksi berada dalam bentuk larutan, maka mol larutan dapat dinyatakan sebagai:
n = V . M

pada akhirnya kelompok topi jerami akan memiliki 10 kru..
menurut saya hancock akan bergabung dengan mereka..dan kru satunya lagi mungkin akan ditemukan di sebuah tempat di “Dunia Baru”….
seluruh sichibukai akan dikalahkan oleh kelompok Topi Jerami dan kelompok Shanks…
sedangkan World Govt akan dkalahkan kelompok Whitebeard dan kelompok bajak laut 11 Supernovas atas dendam mereka ( Whitebeard tidak terima Ace hampir mati, sedangkan 11 supernovas membalas dendam akan kekalahan mereka saaat melawan kizaru)
Kemudian akan terkuak rahasia besar dunia 400 tahun yang lalu
anda bisa menggunakan flashvortex.com untuk mendapatkan icon sepeti yang ada di bagian atas blog ini,
caranya mudah kunjungi
Kelompok Bajak Laut Topi Jerami adalah kelompok bajak laut fiktif yang ada dalam cerita manga dan anime One Piece.
Sebagai kapal dari kelompok ini sekarang adalah Thousand Sunny. Dibuat dari kayu terbaik di dunia yang digunakan untuk membuat kapal Oro Jackson milik
One Piece diciptakan oleh
sedikit biodata tentang yosi dwi putra
- Nama : yosi dwi putra
- Alamat : aspa sma 3 kayuagung
- kelas : XI A 1 (H?POTEXIST CLASS)
- agama : islam
- hobi : baca manga
- Pekerjaan : masih pelajar
- cita-cita : menjadi seorang ahli farmasi








 Ikatan Hidrogen dan ikatan Van der Waals Gaya antarmolekul adalah gaya elektromagnetik yang terjadi antara molekul atau antara bagian y...
Ikatan Hidrogen dan ikatan Van der Waals Gaya antarmolekul adalah gaya elektromagnetik yang terjadi antara molekul atau antara bagian y...
 http://kimia-asyik.blogspot.com/search/label/Soal-Soal Soal Ulangan Hidrokarbon 1. Tentukan jumlah atom C primer, sekunder, tersie...
http://kimia-asyik.blogspot.com/search/label/Soal-Soal Soal Ulangan Hidrokarbon 1. Tentukan jumlah atom C primer, sekunder, tersie...
 Kimia inti adalah kajian mengenai perubahan-perubahan dalam inti atom. Perubahan ini disebut reaksi inti. Peluruhan radioaktif dan t...
Kimia inti adalah kajian mengenai perubahan-perubahan dalam inti atom. Perubahan ini disebut reaksi inti. Peluruhan radioaktif dan t...
 Kelompok Bajak Laut Topi Jerami adalah kelompok bajak laut fiktif yang ada dalam cerita manga dan anime One Piece . kelompok bajak l...
Kelompok Bajak Laut Topi Jerami adalah kelompok bajak laut fiktif yang ada dalam cerita manga dan anime One Piece . kelompok bajak l...
 http://kimia-asyik.blogspot.com/2010/01/hidrolisis-garam.html Reaksi asam dan basa menghasilkan garam. Asam terdiri dari asam kuat dan as...
http://kimia-asyik.blogspot.com/2010/01/hidrolisis-garam.html Reaksi asam dan basa menghasilkan garam. Asam terdiri dari asam kuat dan as...






