1. Tentukan jumlah atom C primer, sekunder, tersier dan kuartener dari senyawa berikut !
.......CH3 CH3..CH3 CH3
..........I...I...........I...I
CH3-CH-C-CH2-CH-C-CH2-CH3
..............I...............I
............CH3...........CH3
......................I I....I
CH3-CH2-CH-CH-CH-CH-CH3
............. ...I.................I
...............CH3............CH3
b...........CH3......CH3
...............I..........I
CH3-CH2-C-CH2-CH-CH2-CH3
................I
..............C2H5.
3. Tulislah struktur dari senyawa berikut!
a. 2,3-dimetil pentana b. 3-etil-2,4,4-trimetil heptana
4. Berilah nama dari struktur senyawa berikut!
a...CH3..............................C2H5
.........I................................I...........
CH3-C=C –CH2-CH3 b. CH2=C-C-CH3
.................I..........................................I
...........CH3...........................CH3
5. Buatlah struktur dari nama senyawa di bawah ini!
a. 3,3-dimetil-1-butena b. 2,3,4-trimetil-1-pentena
6. Berilah nama dari struktur senyawa berikut !
............CH3
...............I
a. CH≡C-C-CH3 b. CH3-C≡C-CH-CH3
...............I............................I
.............CH3......................CH3
7. Buatlah isomer posisi dan cabang dari C5H8
8. Tulislah isomer geometri dari CHCl=CHCl
9. Selesaikan persamaan reaksi oksidasi sempurna berikut!
C3H8 + O2 →
10. Selesaikan reaksi substitusi dari :
Propana + Cl2




 Ikatan Hidrogen dan ikatan Van der Waals Gaya antarmolekul adalah gaya elektromagnetik yang terjadi antara molekul atau antara bagian y...
Ikatan Hidrogen dan ikatan Van der Waals Gaya antarmolekul adalah gaya elektromagnetik yang terjadi antara molekul atau antara bagian y...
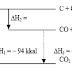 http://kimia-asyik.blogspot.com/search/label/Soal-Soal Soal Ulangan Hidrokarbon 1. Tentukan jumlah atom C primer, sekunder, tersie...
http://kimia-asyik.blogspot.com/search/label/Soal-Soal Soal Ulangan Hidrokarbon 1. Tentukan jumlah atom C primer, sekunder, tersie...
 Kimia inti adalah kajian mengenai perubahan-perubahan dalam inti atom. Perubahan ini disebut reaksi inti. Peluruhan radioaktif dan t...
Kimia inti adalah kajian mengenai perubahan-perubahan dalam inti atom. Perubahan ini disebut reaksi inti. Peluruhan radioaktif dan t...
 Kelompok Bajak Laut Topi Jerami adalah kelompok bajak laut fiktif yang ada dalam cerita manga dan anime One Piece . kelompok bajak l...
Kelompok Bajak Laut Topi Jerami adalah kelompok bajak laut fiktif yang ada dalam cerita manga dan anime One Piece . kelompok bajak l...
 http://kimia-asyik.blogspot.com/2010/01/hidrolisis-garam.html Reaksi asam dan basa menghasilkan garam. Asam terdiri dari asam kuat dan as...
http://kimia-asyik.blogspot.com/2010/01/hidrolisis-garam.html Reaksi asam dan basa menghasilkan garam. Asam terdiri dari asam kuat dan as...






