Beberapa faktor yang mempengaruhi kecepatan reaksi antara lain konsentrasi, sifat zat yang bereaksi, suhu dan katalisator.
A. KONSENTRASI
Dari berbagai percobaan menunjukkan bahwa makin besar konsentrasi zat-zat yang bereaksi makin cepat reaksinya berlangsung. Makin besar konsentrasi makin banyak zat-zat yang bereaksi sehingga makinbesar kemungkinan terjadinya tumbukan dengan demikian makin besar pula kemungkinan terjadinya reaksi.
B. SIFAT ZAT YANG BEREAKSI
Secara umum dinyatakan bahwa:
| - | Reaksi antara senyawa ion umumnya berlangsung cepat. Hal ini disebabkan oleh adanya gaya tarik menarik antara ion-ion yang muatannya berlawanan. Contoh: Ca2+(aq) + CO32+(aq) ® CaCO3(s) Reaksi ini berlangsung dengan cepat. |
| - | Reaksi antara senyawa kovalen umumnya berlangsung lambat. Hal ini disebabkan karena untuk berlangsungnya reaksi tersebut dibutuhkan energi untuk memutuskan ikatan-ikatan kovalen yang terdapat dalam molekul zat yang bereaksi. Contoh: CH4(g) + Cl2(g) ® CH3Cl(g) + HCl(g) Reaksi ini berjalan lambat reaksinya dapat dipercepat apabila diberi energi misalnya cahaya matahari. |
C. SUHU
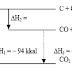
Pada umumnya reaksi akan berlangsung lebih cepat bila suhu dinaikkan. Dengan menaikkan suhu maka energi kinetik molekul-molekul zat yang bereaksi akan bertambah sehingga akan lebih banyak molekul yang memiliki energi sama atau lebih besar dari Ea. Dengan demikian lebih banyak molekul yang dapat mencapai keadaan transisi atau dengan kata lain kecepatan reaksi menjadi lebih besar. Secara matematis hubungan antara nilai tetapan laju reaksi (k) terhadap suhu dinyatakan oleh formulasi ARRHENIUS:
| k = A . e-E/RT |
dimana:
k : tetapan laju reaksi
A : tetapan Arrhenius yang harganya khas untuk setiap reaksi
E : energi pengaktifan
R : tetapan gas universal = 0.0821.atm/moloK = 8.314 joule/moloK
T : suhu reaksi (oK)
k : tetapan laju reaksi
A : tetapan Arrhenius yang harganya khas untuk setiap reaksi
E : energi pengaktifan
R : tetapan gas universal = 0.0821.atm/moloK = 8.314 joule/moloK
T : suhu reaksi (oK)
D. KATALISATOR
Katalisator adalah zat yang ditambahkan ke dalam suatu reaksi dengan maksud memperbesar kecepatan reaksi. Katalis terkadang ikut terlibat dalam reaksi tetapi tidak mengalami perubahan kimiawi yang permanen, dengan kata lain pada akhir reaksi katalis akan dijumpai kembali dalam bentuk dan jumlah yang sama seperti sebelum reaksi.
Fungsi katalis adalah memperbesar kecepatan reaksinya (mempercepat reaksi) dengan jalan memperkecil energi pengaktifan suatu reaksi dan dibentuknya tahap-tahap reaksi yang baru. Dengan menurunnya energi pengaktifan maka pada suhu yang sama reaksi dapat berlangsung lebih cepat.
0 Comments:
Langganan:
Posting Komentar (Atom)

 Ikatan Hidrogen dan ikatan Van der Waals Gaya antarmolekul adalah gaya elektromagnetik yang terjadi antara molekul atau antara bagian y...
Ikatan Hidrogen dan ikatan Van der Waals Gaya antarmolekul adalah gaya elektromagnetik yang terjadi antara molekul atau antara bagian y...
 http://kimia-asyik.blogspot.com/search/label/Soal-Soal Soal Ulangan Hidrokarbon 1. Tentukan jumlah atom C primer, sekunder, tersie...
http://kimia-asyik.blogspot.com/search/label/Soal-Soal Soal Ulangan Hidrokarbon 1. Tentukan jumlah atom C primer, sekunder, tersie...
 Kimia inti adalah kajian mengenai perubahan-perubahan dalam inti atom. Perubahan ini disebut reaksi inti. Peluruhan radioaktif dan t...
Kimia inti adalah kajian mengenai perubahan-perubahan dalam inti atom. Perubahan ini disebut reaksi inti. Peluruhan radioaktif dan t...
 Kelompok Bajak Laut Topi Jerami adalah kelompok bajak laut fiktif yang ada dalam cerita manga dan anime One Piece . kelompok bajak l...
Kelompok Bajak Laut Topi Jerami adalah kelompok bajak laut fiktif yang ada dalam cerita manga dan anime One Piece . kelompok bajak l...
 http://kimia-asyik.blogspot.com/2010/01/hidrolisis-garam.html Reaksi asam dan basa menghasilkan garam. Asam terdiri dari asam kuat dan as...
http://kimia-asyik.blogspot.com/2010/01/hidrolisis-garam.html Reaksi asam dan basa menghasilkan garam. Asam terdiri dari asam kuat dan as...






